
狂犬病病毒抗原检测试剂盒——狂犬病疫苗体外效力评价新方法
狂犬病是一种致命性人兽共患病,疫苗接种是预防狂犬病的主要手段。而疫苗的有效性,则直接依赖于其抗原含量与质量。云菱生物开发的狂犬病病毒抗原检测试剂盒,提供了一种基于G 蛋白定量检测的疫苗体外效力评价方法,适用于不同生产商、病毒株和细胞系生产的狂犬病疫苗,为推动疫苗质量控制与研发提供了重要工具。
1. 预期用途
本试剂盒适用于不同生产商、病毒株和培养细胞系生产的狂犬病疫苗的G蛋白含量的测定。
G蛋白是狂犬病病毒表面的一种关键糖蛋白,作为诱导机体产生中和抗体的保护性抗原,其含量可直接反映疫苗的免疫原性。因此,通过测定G蛋白实现对抗原含量的评估,已成为衡量狂犬病疫苗有效性的关键指标之一,也与疫苗的实际免疫效果密切相关。


图1 第二十四界中国生物制品大会产品展
2. 应用场景
本试剂盒适用于以下环节:
Ø 疫苗临床前研究:抗原完整性检测、抗原回收率检测;
Ø 生产质量控制:收获液、浓缩液、灭活液、原液抗原含量的质控监测;
Ø 疫苗体外相对效力:ELISA 评估的G蛋白含量与NIH试验之间存在良好的相关性[1-2],因此该方法适用于体外评价疫苗效力,可以补充甚至部分取代NIH试验。
狂犬病疫苗从研发到上市设计的环节包括临床前研究、临床试验审批(IND)、临床试验I期、临床试验Ⅱ期、临床试验Ⅲ期、新药申请(NDA)、新药批准等。

图2 一支疫苗的诞生
国内主要使用的狂犬病疫苗为人二倍体疫苗和Vero细胞纯化疫苗[3](5种毒株,2种自主专利)。以国内较为成熟的Vero细胞狂犬疫苗为例,对疫苗生产工艺流程进行介绍。
(1) Vero细胞复苏及扩增传代;
(2) 病毒培养、接种:将人用狂犬疫苗减毒株稀释到适宜浓度后,接种于工作代Vero细胞上;
(3) 病毒收获:接种后的Vero细胞经培养,更换维持液后,进行多次病毒液收获;
(4) 病毒收获液合并、浓缩及灭活:将检定合格的同一细胞批生产的病毒收获液合并,经超滤或其他方法浓缩至规定的蛋白质含量范围后灭活;
(5) 病毒纯化:完全灭活后的病毒液经柱色谱法等方法进行纯化,调节PH值并加入人血白蛋白等稳定剂制备为原液;
(6) 半成品制备:将原液按照要求的同一蛋白含量或抗原含量进行配制,且总蛋白含量应不高于80μg/剂,加入适宜的稳定剂即为半成品;
(7) 分装、包装成品。
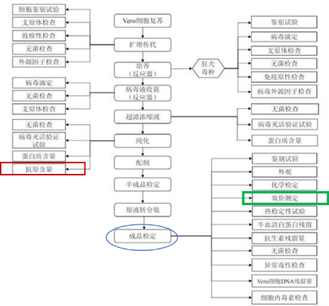
图3 狂犬疫苗制备工艺流程图
4. 试剂盒核心优势
本公司推出的狂犬病病毒抗原检测试剂盒具有以下优势[4]:
l 适用范围广:可定量检测来自不同生产商、病毒株和培养细胞系生产的狂犬病疫苗的G蛋白含量,检测结果灵敏度相当,变异程度小;
l 灵敏度高:以WHO抗原标准品为参考,最低检测限为0.003125IU/ml,灵敏度明显高于其他市售的G蛋白含量定量试剂盒;
l 特异性强:仅识别狂犬病病毒G蛋白,不受其他成分干扰;
l 精密度好:高浓度及低浓度标准试剂的日内和日间变异系数(CV)均在15%以内;
l 操作简便:无需动物试验、省时省力,操作简单且较为安全,伦理审查遵循“3R“原则。
参考文献:
[1]. LIU Y X, HUANG H, SHU-YUN L I. Papid Quantitative Assay of Rabies Post vaccination Antibody by ELISA [J]. CHINESE JOURNAL OF VACCINES AND IMMUNIZATION, 1988;3:40-43.
[2]. WOOD J M, SCHILD G C, NEWMAN R W, et al. An improved single-radial immunodiffusion technique for the assay of influenza haemagglutinin antigen: application for potency determinations of inactivated whole virus and subunit vaccines [J]. J Biol Stand, 1977, 5(3): 43-42.
[3].王传林. 狂犬病疫苗研究进展 [J] . 中华实验和临床病毒学杂志, 2018, 32(3) : 323-327. DOI: 10.3760/cma.j.issn.1003-9279.2018.03.024.
[4]. 王佑春,黄维金,蔡美娜,李玉华,曹守春,谢婧书,刘玉翠,杨毅,乔杉,任晋凯,史巧云,张晓磊. 抗狂犬病毒的抗体及其应用[P].中国专利:CN115925908A, 2023-04-07.









